Struktur atom
Atom terdiri dari nukleus dengan muatan positif yang dikelilingi muatan negatif dari elektron pada jarak yang relatif jauh. Nukleus terdiri atas partikel subatomik yang disebut neutron, bermuatan netral, dan proton, bermuatan positif. Suatu atom dapat dijelaskan dengan nomor atom (Z) yang menggambarkan jumlah proton dalam inti atom, dan nomor massa (A) yang menggambarkan jumlah total proton dan neutron. Setiap atom dalam senyawa apapun memiliki nomor atom tetap, misalnya 1 untuk hidrogen, 6 untuk karbon, 17 untuk klorida, dan sebagainya, tetapi mereka dapat memiliki nomor massa berbeda tergantung berapa banyak neutron yang dimilikinya. Atom-atom yang memiliki nomor atom sama tetapi nomor massa berbeda disebut isotop.
Konfigurasi Elektron dalam Atom
Konfigurasi elektron menggambarkan penataan energi terendah dari suatu atom. Dengan kata lain, konfigurasi elektron memperlihatkan bagaimana pengisian elektron dalam orbital. Elektron yang tersedia diisikan ke dalam orbital dengan mengikuti tiga aturan:
1. Orbital dengan energi paling rendah diisi pertama kali (prinsip Aufbau)
2. Hanya ada dua elektron yang dapat mengisi orbital yang sama, dan keduanya harus memiliki spin yang berlawanan (larangan Pauli)
3. Jika ada dua atau lebih orbital pada tingkat energi yang sama, satu elektron mengisi masing-masing orbital secara paralel hingga semua orbital setengah penuh (aturan Hund)
Perkembangan Teori Ikatan Kimia
Pada pertengahan abad 18, ilmu kimia berkembang dengan pesat. Para ahli kimia mulai menyelidiki tentang kekuatan dalam molekul. Pada tahun 1858, August Kekule dan Archibald Couper secara terpisah mengusulkan bahwa di dalam senyawa organik, atom karbon selalu memiliki empat unit afinitas. Dengan demikian, atom karbon adalah tetravalen, selalu membentuk empat ikatan ketika berinteraksi dengan unsur lain membentuk senyawa. Lebih dari itu, Kekule menyatakan bahwa atom karbon dapat berikatan satu dengan lainnya membentuk rantai panjang. Teori Kekule-Couper kemudian diperluas karena adamya kemungkinan suatu atom membentuk ikatan rangkap. Emil Erlenmeyer mengusulkan ikatan rangkap tiga pada ikatan karbon-karbon pada senyawa asetilen, dan Alexander Crum Brown mengusulkan ikatan karbon-karbon rangkap dua pada senyawa etilen. Pada tahun 1865, Kekule menjelaskan bahwa rantai karbon dapat membentuk double back membentuk cincin.
Mengapa atom-atom berikatan satu sama lain? Atom membentuk ikatan karena senyawa yang dihasilkan lebih stabil dibandingkan atom tunggal. Saat berikatan, orbital masing-masing atom bergabung membentuk orbital baru, yaitu orbital molekul. Ikatan yang dibentuk suatu unsur dapat berupa ikatan ion maupun ikatan kovalen, tergantung pada seberapa besar perbedaan harga keelektronegatifan dari unsur-unsur yang berikatan tersebut. Bila perbedaan kelektronegatifannya kecil, seperti yang umumnya terjadi dalam senyawa organik, maka unsur-unsur tersebut membentuk ikatan kovalen.
Ikatan yang dapat dibentuk oleh unsur yang memiliki energi ionisasi rendah dengan unsur yang memiliki afinitas elektron tinggi disebut ikatan ionik. Contohnya adalah natrium klorida (NaCl). Di dalam molekul NaCl, ion Na+ dan Cl- berikatan melalui gaya elektrostatik. Contoh lainnya yang mirip dapat dilihat pada ikatan potassium fluorida (K+F- ) dan litium bromida (Li+ Br-).
Untuk ikatan kovalen mari kita lihat satu contoh ikatan dalam metana (CH4). Ikatan antara C dengan H bukan ikatan ionik karena atom C sangat sulit melepas atau menerima empat elektron untuk membentuk konfigurasi gas mulia. Faktanya, atom karbon berikatan bukan melalui pemberian atau pelapasan elektron, tetapi dengan sharing elektron satu sama lain yang disebut dengan ikatan kovalen. Ikatan kovalen terbentuk dari overlap dua buah orbital yang masing-masing berisi satu elektron (setengah penuh).
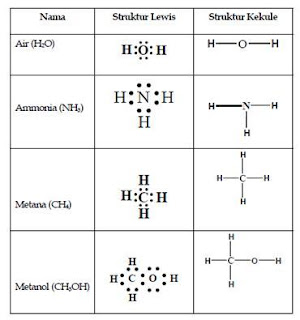
Cara sederhana menggambarkan ikatan kovalen dapat dilakukan dengan menggambar struktur Lewis, di mana elektron-elektron pada orbital terluar digambarkan sebagai titik. Dengan demikian, atom hidrogen memiliki 1 titik, karbon memiliki 4 titik, oksigen 6 titik, dan sebagainya. Molekul stabil menghasilkan konfigurasi gas mulia pada masing-masing atomnya. Contohnya adalah sebagai berikut:
Model penggambaran lain adalah menggunakan struktur Kekule, di mana ikatan digambarkan sebagai sebuah garis. Dengan demikian dalam sebuah ikatan (garis) terdapat sepasang elektron. Pada struktur Kekule, pasangan elektron bebas pada kulit terluar dapat diabaikan.
Polarisasi dan Elektronegativitas
Ikatan dalam natrium klorida adalah ikatan ionic. Natrium menransfer elektron ke klorin menghasilkan Na+ dan Cl-, yang akan terikat satu sama lain karena adanya gaya tarik elektrostatik yang kuat. Ikatan C-C dalam etana merupakan contoh ikatan kovalen. Elektron dalam ikatan tersebut dimiliki bersama oleh kedua atom C. Akibatnya terjadi distribusi elektron yang simetris di dalam ikatan. Ikatan kovalen polar artinya elektron ikatan dipegang lebih kuat oleh salah satu atom, mengakibatkan distribusi elektron di antara kedua atom tidak simetris.
Polaritas ikatan ditentukan oleh elektronegativitas atom-atom yang terlibat. Seperti karbon dan hidrogen memiliki elektronegativitas yang mirip, sehingga ikatan C-H relatif nonpolar. Unsur-unsur yang berada pada bagian kanan dalam tabel periodik, seperti oksigen, fluorin, dan klorin memiliki kemampuan menarik elektron (elektronegativitas) lebih besar dibandingkan dengan karbon. Dengan demikian, ketika atom karbon berikatan dengan salah satu dari atom tersebut maka terbentuk ikatan yang terpolarisasi. Elektron akan cenderung tertarik ke atom yang lebih elektronegatif. Dalam molekul tersebut, atom karbon bermuatan parsial positif (δ+)dan atom yang lebih elektronegatif bermuatan parsial negatif (δ-). Contohnya, ikatan C-Cl adalah ikatan polar.
Unsur-unsur yang berada pada bagian kiri dalam tabel periodic bersifat kurang elektronegatif dibandingkan karbon. Dengan demikian, ketika karbon berikatan dengan mereka, elektron akan cenderung tertarik ke karbon dan mengakibatkan atom karbon bermuatan parsial negatif.
#Handout Kuliah Kimia Organik




 Previous Article
Previous Article




Mksh yup
8 Januari 2020 pukul 11.30
Posting Komentar